
 |
|
|
Главная --> Справочник терминов Конденсация ароматических 2. Конденсация альдегидов с натриевыми солями карбоновых кислот под влиянием ангидридов кислот. Этот синтез, известный под на- Конденсация альдегидов с ж-диаминобензолом и его производными, приводящая к образованию акридиновых красителей, описана в гл. 49. Скорость второй стадии реакции в значительной степени определяется доступностью реакционного центра и частичным положительным зарядом на атакуемом атоме углерода карбонильного компонента. Поэтому конденсация альдегидов протекает с большей скоростью, чем конденсация кетонов, где обе стадии реакции протекают с соизмеримыми скоростями. Конденсация альдегидов и кетонов широко применяется в промышленности для получения некоторых важных продуктов органического синтеза. Так, например, из уксусного альдегида получают кротоновыи альдегид, который восстанавливают в бутиловый спирт. Бутиловый спирт и его производные применяются в качестве растворителей и пластификаторов. Альдольная и кретоновая конденсации. Реакция Канниццаро. Особенности конденсации кетонов. Реакция Перкина. Конденсация альдегидов и кетонов с ароматическими аминами и фенолами. ТЪи-фенилметановые красители и их синтез. Лейкосоединения. Карбиноль-ные основания. Фталеины. Образование оснований Шиффа. Сложно-эфирная конденсация. 6. Конденсация альдегидов с эфирами монохлоруксусной кислоты (синтез Дарзана). 3. Конденсация альдегидов с малоновой кислотой: Конденсация альдегидов и кетонов, обычно не содержащих а-атом водорода, с соединениями типа Z—СН2—Z' или Z— —CHR—Z' называют, как правило, реакцией Кнёвенагеля [410], однако некоторые ограничивают использование этого названия реакциями лишь определенных метиленовых компонент. Группы Z и Z' могут быть СНО, COR, COOH, COOR, CN, N02 [411], SOR, SO2R, SO2OR и др. Если Z = COOH, то часто in situ происходит декарбоксилирование продукта. При использовании достаточно сильного основания реакцию можно провести и с соединениями, содержащими только одну группу Z: CH3Z или RCIHbZ. Можно использовать и другие соединения с активным водородом, среди которых хлороформ, 2-метилпиридины, терминальные ацетилены, циклопентадиены и т. д. На деле 16-44. Конденсация альдегидов с N-ацилглицинами (реакция Эрленмейсра) 11-32. Перегруппировка сложных эфиров фенолов (реакция Фриса) 12-17. Алкилирование енаминов эпоксидами 14-4. Гидроксилирование кетонов 16-26. Моновосстановление а-дикетонов 16-30. Присоединение RLi и СО к кетонам 16-40. Конденсация альдегидов и (или) кетонов (альдоли) 16-42. Реакция кетонов с тозилметилазидом и этилатом таллия с последующим гидролизом; реакция альдегидов, кетонов или сложных эфиров с метоксивиниллитием 16-46. Конденсация формальдегида с альдегидами или кетонами (реакция 15-37. Эпоксидирование а, [5-ненасыщенных сложных эфнров 16-45. Конденсация альдегидов или кетонов с а-галогенозамещенными сложными эфирами (реакция Дарзана) Реакция Перкина. Среди реакций конденсации, протекающих в присутствии основных катализаторов, важное место занимает конденсация ароматических альдегидов с ангидридами алифатических кислот, приводящая к образованию непредельных 3-арилалкиловых кислот. Реакция проводится при нагревании в присутствии натриевой или калиевой соли кислоты, ангидрид которой Конденсация ароматических соединений с альдегидами или кетонами называется гидроксиалкилированием [295]. Эта реакция используется для синтеза спиртов [296], хотя часто первоначально образующийся спирт взаимодействует с другой молекулой ароматического соединения (реакция 11-13), давая продукт диарилирования. Для этой цели реакция оказывается весьма полезной, примером может служить синтез ДДТ: Конденсация ароматических альдегидов с ангидридами называется реакцией Перкина [458]. Если ангидрид содержит два а-атома водорода (как показано), то всегда происходит дегидратация; соль р-гидроксикислоты никогда не выделяют. В некоторых случаях в реакцию вводились ангидриды типа (RaCHCObO, и тогда продуктом является гидроксисоединение, поскольку дегидратация в этом случае невозможна. Основанием в реакции Перкина почти всегда служит натриевая или калиевая соль кислоты, соответствующей вводимому в реакцию ангидриду. Помимо ароматических альдегидов в реакцию вступают и их винилоги АгСН = СНСНО. С другими алифатическими альдегидами реакция не идет [459]. Побочно вместо простой дегидратации может идти декарбоксилирование первоначально образующейся соли 3-гидроксикислоты. Иногда это направление является основным: Важной вариацией реакции Перкина является синтез азлак-тонов по Эрленмейеру [460]. В этой реакции происходит конденсация ароматических альдегидов с N-ацилпроизводными глицина в присутствии уксусного ангидрида и ацетата натрия. Продуктом реакции является азлактон: 16-55. Конденсация ароматических альдегидов (бензоины) 16-71. Реакция металлированных альдиминов с альдегидами или эпоксидами 18-4. Перегруппировка а-гидроксиальдегидов или а-гидроксикетонов 18-7. Реакция бензилов с реактивами Гриньяра 19-20. Окисление эпоксидов 19-23. Окисление алкенов 19-66. Конденсация сложных эфиров (ацилоин) Бензоиновая конденсация. Еще одним примером присоединения карбаниона является конденсация ароматических альдегидов в спиртовом растворе в присутствии ~CN: Наибольший интерес в препаративном отношении эта конденсация имеет в ароматическом ряду; впервые она была проведена с бенаалъдегидом. Алифатические альдегиды обычно не вступают в эту реакцию. Одним из немногих исключении, когда бензоиновая конденсация гладко протекает не с чисто ароматическими альдегидами, является конденсация ароматических гдиоксалеж типа фенгтдглиоксаля [83]. Способ проведения реакции ацилирования в основном не отличает-. ся от способа, применяемого при реакции алкилирования. Конденсация ароматических соединений с ацилирующими агентами, как и с алкили-рующими, является реакцией экзотермической, и поэтому хлорангид.-рид или ангидрид кислоты необходимо прибавлять к смеси ароматического соединения и катализатора постепенно, по каплям. По окончании, добавления ацилирующего агента реакционную смесь нагревают на водяной бане от 1 до 3 часов, т. е. немного дольше, чем при алкшшровании. Продолжительное нагревание (до прекращения выделения хлористого водорода) часто отрицательно влияет на выход кетона, так как при этом' образуются высококипящие продукты ос^Циения. При синтезе ацетофе-нона из высококипящей^ фракции выделен дипион С6Н5С=СНСОС6 Н5— Бензоиновая конденсация. Еще одним примером присоединения карбаниона является конденсация ароматических альдегидов в спиртовом растворе в присутствии ~CN: : ,,.Легкость образования карбанионов зависит от электроноакцеп-!да!рнь1х свойств заместителя X, а также от стабилизации карба-ннона за счет делокализации отрицательного заряда. Конденсация ароматических альдегидов с алифатическими (реакция Кляйзена — 'Шмидта), а также с ангидридами карбоновых кислот (реакция ^Церкина) протекает по типу альдольной конденсации, только про-"ДуктЫ этого взаимодействия быстро превращаются в а, р-ненасы-;?ренные соединения. В этих реакциях ароматические альдегиды вы-?-егупают в качестве карбонильного компонента. Такую же роль в реакциях с соединениями, содержащими активные метиленовые ;группы (альдегидами, кетонами, нитрилами, сложными эфирами), играют сложные зфиры. Конденсация альдегидов с ароматическими аминами и фенолами протекает в присутствии кислот. Так, в ;:случае формальдегида образуется реакционноспособный гидрокси-:Метилкатион [Конденсация ароматических альдегидов с формальдегидом может протекать по схеме 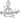 Конденсация приводящая Конденсацией этилового Конденсацией бензальдегида Конденсации янтарного Конденсации алифатических Конденсации фурфурола Конденсации используют Конденсации моносахаридов Конденсации первичного |
- |