
 |
|
|
Главная --> Справочник терминов Переходных состояния В случае же взаимодействия /раис-1-нитроиентена-1 с симметричным диеном, например с 2,3-диметилбутадиеном, образуется эквимольная смесь ад-дуктов, получающихся с участием переходных состояний I и II. Картина существенно меняется при использовании в качестве восстановителя реактива Гриньяра (38). Казалось бы, при образовании переходного состояния в данном случае должны были бы возникать еще большие пространственные затруднения, так как в соединении (38) ^-углеродный атом связан с более объемистым erop-бутильным радикалом. Однако в данном случае у р-угле-родного атома имеются два атома водорода, способных к гидридному переходу. Вследствие этого при атаке пинаколина соединением (38) как с одной, так и с другой стороны плоской молекулы кетона возможно образование переходных состояний, свободных от пространственных затруднений, в которых гид- Для основной и промежуточных реакций пишутся полные уравнения реакций со стехиометрическими коэффициентами, с указанием механизма и переходных состояний процесса (если это известно) и использованием структурных формул. Для алифатических систем, не обладающих столь жесткой геометрией, как бициклооктан, попытки приложения указанных закономерностей натолкнулись на значительные трудности. Задача была решена Тафтом путем анализа процесса кислотного и основного гидролиза сложных эфиров алифатических карбоновых кислот. Было обнаружено значительное сходство переходных состояний этих реакций Реакции, в которых образуются интермедиа™, являются двухстадийными (или многостадийными) процессами. Для них характерно наличие так называемой энергетической ямы и двух переходных состояний, каждое из которых обладает более высокой энергией, чем интермедиат (рис. 6.2). Чем глубже яма, тем устойчивее интермедиат. На рис. 6.2, а второй пик выше первого, а на рис. 6.2,6 изображена обратная ситуация. Следует отметить, что в реакциях, где второй пик выше первого, общая величина &СФ меньше суммы величин ДС^ для двух стадий. Минимумы на диаграмме свободной энергии соответствуют реальным частицам, имеющим хотя и очень короткое, но конечное время жизни. Это могут быть карбокатионы, карбанионы, свободные радикалы и тому подобные частицы, рассмотренные в гл. 5, а также молекулы с обычными валентностями составляющих их атомов. В любом случае в условиях реакции это короткоживущие частицы (так как ДОа^ мало), которые быстро превращаются в продукты. Однако максимумы группы в пара-положении толуола (которые должны дестабилизировать положительный заряд) уменьшают скорость отрыва водорода бромом, тогда как электронодонорные группы повышают скорость этого процесса [8]. Однако, как и следовало ожидать, в данном случае заместители оказывают меньшее влияние (р~ —1,4), чем в реакциях, где участвует полностью ионный интермедиат, например в реакция, протекающих по механизму SN! (см. т. 2, разд. 10.11). Другое доказательство полярных переходных состояний в радикальных реакциях отрыва приведено в разд. 14.5. В реакциях отрыва такими радикалами, как метил или фенил, полярные эффекты очень малы или полностью отсутствуют. Так, было показано, что на скорость отрыва водорода от замещенных по кольцу молекул толуола под действием метального радикала относительно мало влияет наличие электронодонорных или электроноакцепторных заместителей [9]. Те радикалы (например, Вг«), которые проявляют тенденцию отрывать электронообогащенные атомы водорода, называют электрофильными радикалами. В этом механизме, называемом Егже.шнмзл1сш, две группы уходят почти одновременно и связываются друг с другом. Это должно быть с«н-элиминирование; в случае четырех- и пяти-членных переходных состояний четыре или пять атомов, образующих цикл, должны лежать в одной плоскости. Для шести-членного переходного состояния копланарность необязательна, поскольку имеется пространство для внешних атомов, когда уходящие атомы сближены (28). ный действием 3-метилпентилмагнийхлорида на пинаколин, действительно оказался оптически неактивным. Однако другие родственные асимметрические реагенты К-(—)-1-хлор-3-фенилпентан и R-(—)-1-хлор-3-фенилбутан (оба в виде соответствующих магнийорганических соединений) при действии на фенилизопропилкетон привели к образованию оптически активного (+)-фенилизопропилкарбинола с оптической чистотой соответственно 29 и 23%. Поскольку асимметрический атом здесь не является участником возникающего шестичлен-ного циклического переходного состояния, прежнее объяснение для этих случаев не подходит. В связи с этим было обращено внимание на то обстоятельство, что в двух возможных переходных состояниях (ведущих к двум антиподным продуктам восстановления) участвуют диастереотопные атомы водорода, что достаточно для обоснования неравноценности обоих переходных состояний (скобкой показана пара диастереотопных атомов водорода, один из которых участвует в гидридном переходе). Известны, однако, примеры, когда реакции не подчиняются этой закономерности. Так, Браун [28] при действии rper-бутилата калия в грег-бутаноле на арилсульфонаты наблюдал преимущественное образование г{«с-олефинов. Он объяснил это тем, что из двух возможных переходных состояний отщепления по механизму ?2 (на примере тозилата пентанола-3) более выгодным оказывается состояние XI, в котором объемистые грет-бутильная и арилсульфоновая группы могут «отвернуться» от находящихся в скошенном положении-к ним радикалов СН3 и С^5, в то время как в переходном состоянии XII объемистые заместители с обеих сторон прикрыты радикалами: Сравните тип заряда переходных состояний этих реакций и выберите наиболее подходящий растворитель для их осуществления: спирт или ацетон. Следует подчеркнуть, что скорость замещения в ароматических соединениях лимитируется образованием переходного состояния, непосредственно предшествующего образованию комплекса Va. Однако мы не располагаем возможностями получения каких-либо данных, непосредственно характеризующих переходное состояние, и можем лишь считать, что это состояние энергетически и структурно сильно не отличается от промежуточного соединения Va (ср. стр. 61). Поэтому а-комплексы типа Va можно использовать в качестве моделей, непосредственно предшествующих им переходных состояний. Поскольку до настоящего времени не отдано предпочтения ни одной из двух наиболее вероятных структур димера [(4) и (в)], ниже приводятся оба возможных переходных состояния (25) и (26) (мостиковые атомы галогена расположены вне плоскости чертежа): Оба переходных состояния имеют одинаковую тетра-эдрическую конфигурацию, и различие в скоростях реакций кислотного и щелочного гидролиза эфиров обусловлено Альтернативный метод расщепления основывается на различиях в скоростях реакций энантиомеров с хиральным агентом. Энергии переходных состояний для реакций одной хиральной молекулы с другой могут быть для энантиомеров различны. Если рацемическая смесь'(Д-мо-лекула + S-молекула) реагирует с оптически активным реагентом (У?-реагент), то два переходных состояния (й-молекула- ¦•¦R-реагент Связь между теорией переходного состояния и механизмом реакции часто иллюстрируют с помощью диаграмм потенциальной энергии. Диаграммы потенциальной энергии для гипотетических одностадийной бимолекулярной и двустадийной реакций показаны на рис. 4.1. Нижняя диаграмма изображает двустадийную реакцию, в которой участвует интермедиат, обладающий конечным временем жизни. В таком случае имеется два переходных состояния. Более высокая энергия активации первого переходного состояния на нижней диаграмме подразумевает. Предпочтительное направление элиминирования в случае ^-механизма зависит от конкретной природы переходного состояния. Два экстремальных переходных состояния для ?2-элиминирования по своему влиянию на ориентацию будут похожи на переходные состояния El- и ?1 cb-механизмов. В случае, близком к «?1 сй-границе» ?2-переходного состояния, между протоном, который должен отщепиться, и основанием имеется сильно развитая связь. Уходящая группа остается еще прочно связанной в субстрате и поэтому образование двойной связи С=С развито слабо. При ацетолизе и-бромбеизолсульфоната дейтерированиого н-бутанола наблюдается 100%-я инверсия конфигурации (1-й пример в табл. 9.7), т.е. в данном случае реализуется ^^-механизм. Однако в примерах 2—5 наблюдаются частичная рацемизация или неполная инверсия. Как можно объяснить частичную рацемизацию? Самое простое объяснение заключается в том, что в этих случаях параллельно реализуются оба механизма — и SV2 и SV1. Одна часть молекул исходного субстрата реагирует по SW1 -механизму с полной рацемизацией, а другая часть — по механизму 5V2 с инверсией конфигурации. Однако с таким предположением трудно согласиться. Так, скорость сольволиза оптически активного 1-фенилэтилхлорида (пример 5) не возрастает при добавлении ацетата натрия, т.е. соли с общим ионом. Добавки ацетата натрия не увеличивают также и степень инверсии в этой реакции. Следовательно, инверсия в данном случае не связана с параллельно реализующимся 5д2-механизмом. Другое объяснение основано на предположении, что частичная рацемизация отражает различие в стабильности карбокатионов. Менее стабильный карбокатион реагирует очень быстро даже тогда, когда одна из его сторон еще экранирована уходящей группой, и атака нуклеофила осуществляется преимущественно с тыльной стороны. При полной диссоциации хирального субстрата образуется ахиральный карбокатион, для которого два альтернативных переходных состояния, соответствующих фронтальной атаке и атаке с тыла, являются энантиомерными и, следовательно, имеют одинаковую энергию. Частичная рацемизация означает, однако, что два переходных состояния имеют разную энергию. Термин «экранирование уходящей группой одной стороны карбокатиона» означает, что уходящая группа в этих переходных состояниях все еще остается связанной с атомом углерода, и ахиральный ион не образуется. Таким образом, на первой, самой медленной стаднн ионизации RZ уходящая группа входит в состав переходного состояния, а интермедиат на рис. 9.6 уже нельзя описать как R+. Предпочтительное направление элиминирования для Е2-механизма зависит от конкретной природы переходного состояния. Два экстремальных переходных состояния El -элиминирования по своему влиянию на направление отщепления будут похожи на переходные состояния ?1и ?1с.5-механизмов. В случае, близком к Е\сВ-границе ?2-переходного состояния, между протоном и основанием имеется сильно развитая связь. Уходящая группа остается еще прочно связанной с субстратом, поэтому образование двойной связи С=С в переходном состоянии развито слабо. В случае, близком к Е\-границе, переходное состояние характеризуется высокой степенью расщепления связи С—X и практически незатронутой связью С—Н. В строго синхронной ?2-реакции двойная углерод-углеродная связь в переходном состоянии уже в основном образована за счет синхронного расщепления обеих связей С—X и С—Н. El -элиминирование, которое протекает через переходное состояние с развитой двойной связью, прнаоднт к наиболее замещенному при двойной связи алкену в качестве основного продукта, поскольку его стабильность отражена и в переходном состоянии. Таким образом, направление синхронного Е2-элиминирования соответствует правилу Зайцева. Это же правило определяет направление .И-элиминирова-ния с Е\-подобным переходным состоянием. Если переходное состояние Е2 -элиминирования имеет явно выраженный Е\сВ-карбанионный характер, направление отщепления определяется легкостью отрыва протона, поэтому в продуктах реакции преобладает наименее замещенный при двойной связи алкен. B соответствин с этим могут быть четыре разных переходных состояния, энергия которых зависит от степени взаимодействия заместителя X с положительным зарядом кольца. В «позднем» переходном состоянии полярный эффект заместителя X должен быть выражен сильнее, чем в «раннем» переходном состоянии, но качественно влияние одного и того же заместителя должно быть одинаковым. В ходе внутримолекулярной перегруппировка мигрирующая группа W все время сохраняет связь с системой А-В, т.е. ст-связь W-B, существующая в конечном продукте, образуется синхронно с разрывом ст-связи W-A. Принципиально возможно представить два альтернатнаных переходных состояния для процесса миграции группы W от А к В: через два различных переходных состояния» Однако, использование бензоилиодида позволило решить поставленную задачу. Реакция между бензоилиодидом и иодом осуществлялась в среде гексана (при 0.25-40 °С), а также в четыреххлористом углероде, хлорбензоле и 1,2-дихлорэтане при 25 °С как в темноте, так и при УФ-облучении. Скорость обменного процесса отвечает более чем первому порядку по бензоилиодиду и промежуточному между первым и вторым порядком по иоду. Результаты темновых и фотоинициируемых реакций практически не различались. Отсутствие фотохимического эффекта опровергало возможность участия в реакции свободных атомов иода. Для нее предложены два паралельных механизма. Один - бимолекулярный, включающий в переходном состоянии одну молекулу бензоилиодида и одну молекулу иода. Второй - трехмолекулярный, предполагающий образование переходного комплекса, состоящего из одной молекулы бензоилиодида и двух молекул иода. Энтропийный фактор реакции, величина предэкспоненты в уравнении Аррениуса свидетельствуют, что оба переходных состояния имеют структуру ионных пар или цвиттер-ионов. Предложено следующее строение переходных состояний для бимолекулярного - 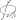 Промежуточного карбокатиона Получаемый действием Получаемый полимеризацией Получаемые полимеризацией Получаемые взаимодействием Получаемых соединений Перегруппировки превращается Получается бесцветный Получается действием |
- |